Bakgrund om sjukdomen
Reumatoid artrit (RA) är en kronisk inflammatorisk sjukdom som vanligtvis drabbar mer än bara lederna. RA är en autoimmun sjukdom, dvs. en sjukdom som beror på oönskad aktivitet i immunsystemet, där immunsystemet av misstag angriper kroppens egna vävnader. RA påverkar ledernas inre beklädnad, vilket orsakar smärtsamma svullnader som så småningom kan resultera i benerosion och deformitet i lederna. RA kopplas ofta till symtom från andra organ som huden, ögonen, lungorna, hjärtat och blodkärlen. Nya typer av läkemedel har visserligen förbättrat behandlingsalternativen, men det finns fortfarande betydande behov som inte tillgodosetts. För de flesta patienter fortsätter RA att förvärras och skadan ackumuleras. Patienterna genomgår återkommande behandlingar och läkemedelsgrupper och måste hantera perioder av akut sjukdomsaktivitet som kallas skov. Dessa skov kan inträffa flera gånger per år och kan leda till att patienten får justera sin dos av det läkemedel hen för närvarande använder eller byta till en ny behandling, i ett försök att behålla kontrollen över sjukdomen.
Klinisk utveckling av resomelagon (AP1189) vid RA
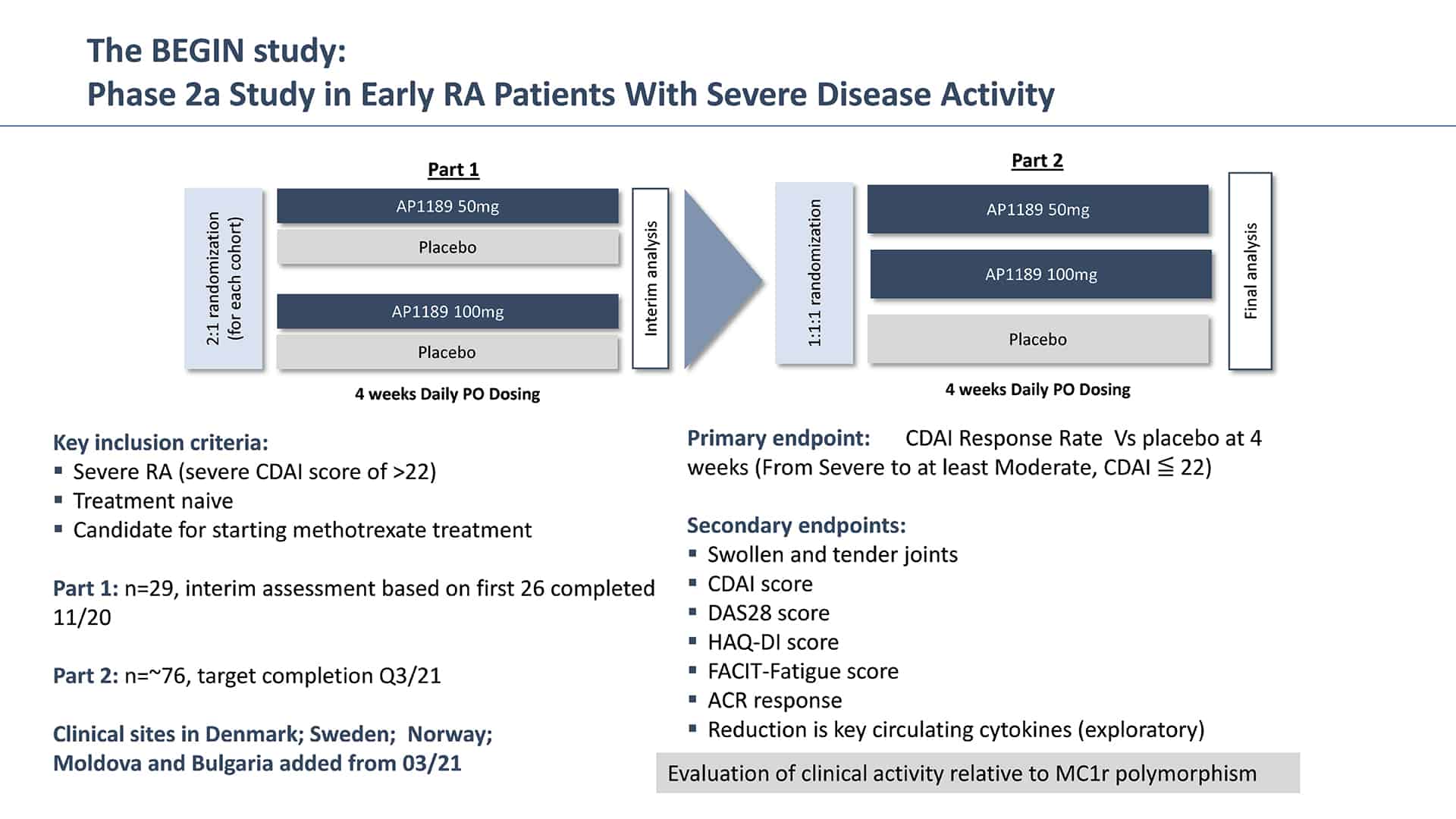
I november 2021 tillkännagav SynAct resultat från fas 2a-studien av resomelagon (AP1189) på nydiagnostiserade och tidigare obehandlade RA-patienter med allvarlig sjukdomsaktivitet. Studien, kallad BEGIN, var en randomiserad, dubbelblind, placebokontrollerad multicenterstudie på tidigare behandlingsnaiva RA-patienter där antingen 50 mg eller 100 mg resomelagon (AP1189) eller placebo administrerades utöver metotrexat (MTX). MTX är ett sjukdomsmodifierande antireumatiskt läkemedel (DMARD) som vanligtvis används som ett första behandlingsalternativ. MTX tenderar att fungera bra hos de flesta patienter, men det kan ta upp till 6-8 veckor för läkemedlet att få full effekt, och upp till 40 % av patienterna kommer inte att uppnå en fullständig respons på MTX-behandling och kommer att kräva dosökning eller tillägg av ytterligare läkemedel, som biologiska terapier som kan inducera en högre grad av immunsuppression.
Resomelagon (AP1189) givet en gång dagligen i fyra veckor visade sig vara säkert och tolererades väl i den applicerade patientpopulationen. 100 mg resomelagon (AP1189) visade en statistiskt signifikant genomsnittlig minskning av det kliniska sjukdomsaktivitetsindexet (CDAI), studiens primära effektmått, från baslinjen till fyra veckor som var mer än 65 % högre än effekten som sågs i den placebobehandlade kontrollgruppen (genomsnittlig minskning av CDAI: resomelagon (AP1189) 100 mg (n=33): 15,5 poäng jämfört med placebo (n=30): 9,3 %, p = 0,0394). 100 mg resomelagon (AP1189)-gruppen visade också en signifikant högre andel patienter som uppnådde ACR20 än placebobehandlade patienter (ACR20: resomelagon (AP1189) (n=33) 100 mg: 60,6%; Placebo (n=30): 33,3%, P=0,0437) inom 4 veckor.
Potentiell nytta av resomelagon (AP1189) vid RA
Den framväxande kliniska profilen hos resomelagon (AP1189) kan potentiellt stödja flera användningsområden vid behandling av RA:
| Framväxande klinisk profil för resomelagon (AP1189) | |
|---|---|
| Oral dosering | oral fast formulering kommer användas i fortsatt utveckling |
| Snabb verkan från första behandling | inom två veckor |
| God respons på behandling | inom fyra veckor |
| Fördelaktig biverkansprofil. Ingen immunhämning |
inga biverkningar som förhindrar fortsatt behandling rapporterade |
| Verkansmekanism utan steroider | potential att vara steroidsparande |
| Kompatibel med MTX | inga kända teoretiska DMARD-läkemedelsinteraktioner |
Fortsatt utveckling
Baserat på resultaten från BEGIN RA-studien har företaget genomfört ytterligare två kliniska fas 2-studier i RA med resomelagon (AP1189).
EXPAND – En 12-veckors fas2b-studie av daglig resomelagon (AP1189) i MTX-naiva patienter med svår sjukdomsaktivitet
EXPAND-studien var utformad för att testa effekten av 12 veckors resomelagon (AP1189)-behandling på sjukdomsaktivitet mätt med ACR20-svarsfrekvensen såväl som andra RA-sjukdomsåtgärder och för att bekräfta molekylens säkerhetsprofil. Figuren nedan ger en översikt över utformningen av fas 2b-studien.
I studien randomiserades 127 patienter med hög sjukdomsaktivitet (CDAI > 22) enligt relationen 1:1 för behandling med 100 mg resomelagon en gång dagligen eller placebo som tillägg till en bakgrundsbehandling med metotrexat (MTX). 54,7% av patienterna som behandlades med 100 mg oralt resomelagon en gång dagligen uppnådde ett ACR20-svar efter 12 veckor jämfört med 55,7% av patienterna som fick placebo.
Resomelagon fortsatte att uppvisa en gynnsam säkerhetsprofil i denna patientgrupp med hög sjukdomsaktivitet. Den totala frekvensen av behandlingsrelaterade allvarliga biverkningar (SAE) var 1,6 % (n=2), med 1 SAE i varje grupp. Den totala frekvensen av patienter som upplevde biverkningar vid behandling var 44,4% och 42,2% för resomelagon- respektive placebobehandlade patienter (alla patienter fick MTX). Det fanns inga observerade tecken på immunsuppression i resomelagon-gruppen utöver det som förknippas med bakgrundsbehandling med metotrexat.
En post hoc-analys genomfördes av behandlingsnaiva patienter med reumatoid artrit som hade en förhöjd basnivå av C-reaktivt protein (CRP > 3 mg/L), en markör för systemisk inflammation, och som registrerades inom 6 månader efter att de fått sin diagnos på reumatoid artrit (RA). I denna undergrupp av patienter uppvisade 100 mg resomelagon dagligen ett konsekvent och statistiskt signifikant behandlingssvar jämfört med placebo i alla utvärderade utfallsmått.
Efter 12 veckor hos EXPAND-patienter med förhöjt CRP vid baslinjen hade gruppen som fick 100 mg resomelagon ett ACR20-resultat på 71% jämfört med 54% hos placebopatienterna. Efter 12 veckor i undergruppen av patienter med förhöjt CRP som rekryterades och vars behandling inleddes inom 6 månader efter RA-diagnosen, uppnådde 23 av 28 (82%) av patienterna som behandlades med 100 mg resomelagon en ACR20 jämfört med 14 av 27 (52%) av placebo-patienterna (P<0,05).
En signifikant skillnad till resomelagons fördel sågs också i de sekundära utfallsmåtten, inklusive minskningen av CDAI (resomelagon 24,6 jämfört med placebo 14,7 poäng, p<0,01), minskningen av DAS28-CRP (resomelagon 1,9 jämfört med placebo 1,2 poäng, p<0,01) och minskningen av HAQ-index för funktionsnedsättning (0,69 jämfört med placebo 0,31 poäng, p<0,05).
Säkerheten i gruppen med förhöjt CRP vid behandling inom 6 månader var jämförbar med vad som tidigare har rapporterats för hela EXPAND-studien.
RESOLVE – 4/12-veckors fas 2a/b studie av daglig resomelagon (AP1189) hos patienter med ofullständigt svar på första linjens sjukdomsmodifierande antireumatiska läkemedel (DMARD-IR) som upplever måttlig till svår sjukdomsaktivitet
En stor andel av patienter som behandlas med DMARD uppnår aldrig den fulla önskade effekten, har en avtagande behandlingseffekt eller lider av biverkningar som kan förhindra fortsatt behandling. Dessa patienter som upplever en otillräcklig respons på DMARD-behandling kallas DMARD-IR (inadequate response).
Företaget tror att resomelagon (AP1189) kan vara mycket väl lämpad för DMARD-IR-patienter med tanke på den framväxande profilen av en effektiv, säker och väl tolererad oral behandling en gång dagligen.
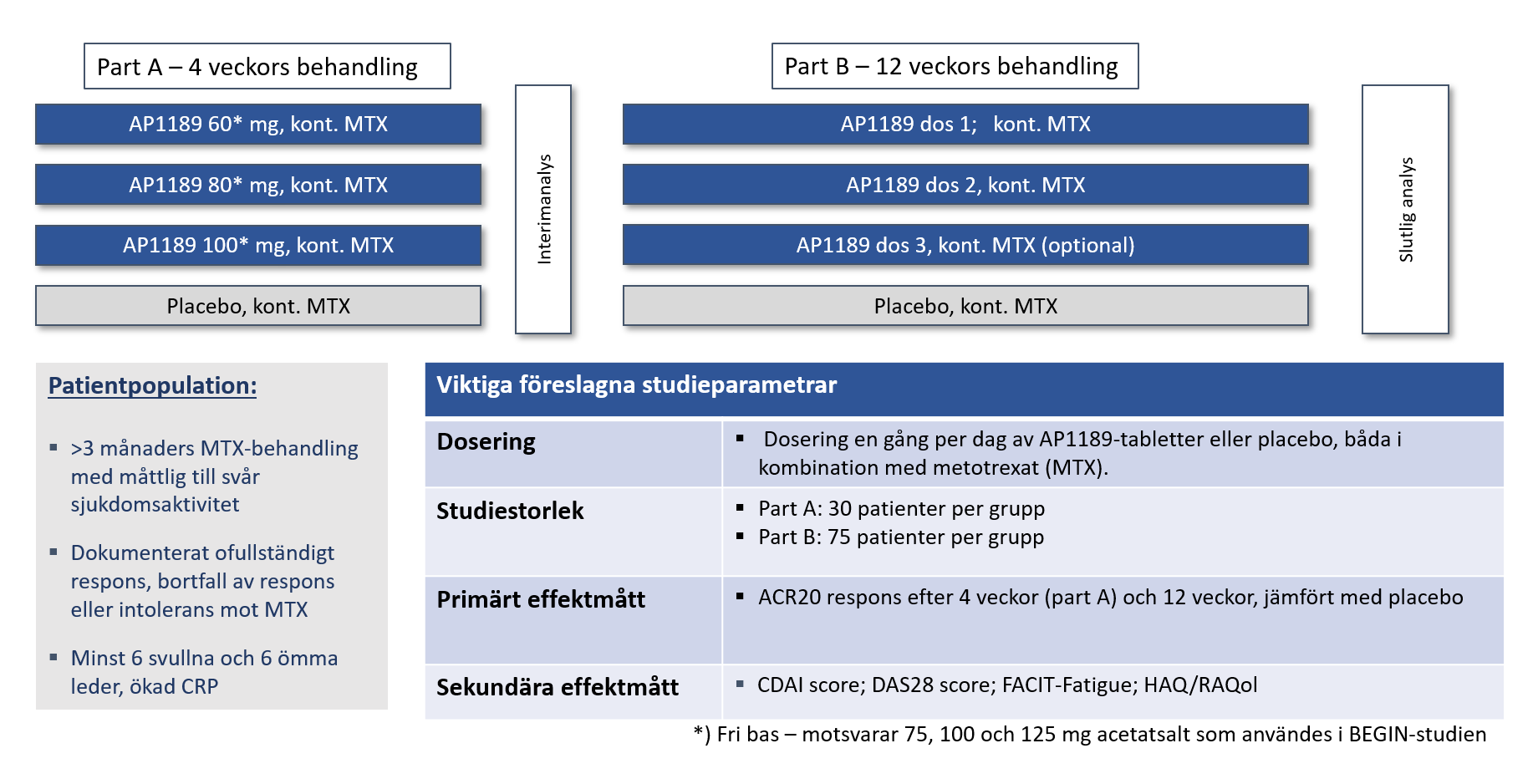
RESOLVE del A genomfördes enligt en amerikansk registreringsansökan (Investigational New Drug Application) som en fyradelad studie hos flera kliniker med behandling med 60 mg, 80 mg, 100 mg resomelagon (AP1189) eller placebo en gång dagligen i 4 veckor. Totalt ingick 125 patienter i studien, varav 107 slutförde Resolve del A enligt protokoll med dagliga doser av placebo, 60 mg, 80 mg eller 100 mg resomelagon i 4 veckor utöver en stabil dos av MTX.
Effektdata från en klinik behövde exkluderas från effektanalyserna. SynAct inväntar nu slutliga effektbedömningar från kontraktsforskningsorganisationen (CRO) med kliniken borttagen från beräkningarna. Studien visade dock en mycket hög placeboeffekt med ACR20, det primära effektmåttet, runt 50% efter en månad och med lägre siffror uppnådda i de tre aktiva grupperna.
Resomelagon fortsatte att vara allmänt säkert och väl tolererat i förhållande till placebo. En allvarlig biverkning (SAE) rapporterades i studien hos en placebobehandlad patient som blev inlagd på sjukhus på grund av svårt förvärrad ledsmärta. Det totala antalet rapporterade behandlingsrelaterade biverkningar (TEAE) var 56 hos de 125 rekryterade patienterna med 16 i placebogruppen och 10, 12 och 18 i grupperna med 60 mg, 80 mg respektive 100 mg resomelagon.
En stor grad av heterogenitet i den rekryterade patientgruppen identifierades vid analys av studien. Två tredjedelar av patienterna hade behandlats med metotrexat (MTX) i mer än ett år vid tidpunkten för rekryteringen, och de flesta patienterna hade behandlats i mer än två år. Endast fem av de rekryterade patienterna hade en sjukdomshistoria där MTX-behandling inletts inom 6 månader efter RA-diagnos. Dessutom stödde den rapporterade sjukdomshistorien inte behandling med maximal tolerabel dos av metotrexat hos en liten andel av de rekryterade patienterna.
Vidare utveckling i fas 2b kommer initialt att fokusera på den patientgrupp som identifierats svara på behandling med resomelagon (AP1189) i EXPAND. Detaljer för hur kommande studier ska utformas håller på att tas fram, för att kunna lämna in en ansökan om klinisk prövning och/eller ett protokoll till relevanta hälsovårdsmyndigheter.
Utvecklingen av resomelagon (AP1189) för behandling av DMARD-IR-patienter är fortfarande en möjlighet, men patientgruppen behöver väljas ut noggrant med hänsyn till substansens verkningsmekanism och nyttan för de patienter som ska behandlas.