Vårt ledande program: Resomelagon (AP1189)
SynActs läkemedelskandidat, resomelagon (AP1189), är en oral selektiv melanokortin-agonist som tas en gång dagligen. Resomelagon (AP1189) stimulerar selektivt de melanokortin-receptorer som är direkt involverade i inflammationen och dess upplösning utan att stimulera binjurarna till att frisätta kortisol. Denna selektivitet gör det möjligt för resomelagon (AP1189) att använda sina antiinflammatoriska och inflammationslösande effekter utan steroider och utan de betydande problemen med säkerhet, tolerabilitet och biverkningar som kopplas till adrenokortikotropt hormon (ACTH) behandlingar. Resomelagon (AP1189) är också en partisk agonist som inte stimulerar melanokortinvägar som är ansvariga för aktivitet som faller utanför det avsedda målet, som hyperpigmentering av huden.
Bolaget utvärderar resomelagon (AP1189) i tre kliniska fas 2-program avseende reumatoid artrit (RA), idiopatisk membranös glomerulonefrit (en form av nefrotiskt syndrom) och virus-inducerad respiratorisk insufficiens (VIRI), som bl a kan orsakas av Covid-19.
Under 2021 slutförde SynAct fas 2a-studier i tidig och svår RA och med patienter som vårdades på sjukhus för Covid-19-inducerad respiratorisk insufficiens. Under samma år, utvecklade och påbörjade SynAct tester av en ny oral tablett-formulering av resomelagon (AP1189) på friska frivilliga och registrerade ytterligare patent som bör ge molekylen exklusivitet till efter 2040.
Under 2023 slutförde företaget två nya kliniska fas 2-studier i RA: EXPAND en fas 2b-studie på nydiagnostiserade RA-patienter som upplever allvarlig sjukdomsaktivitet och del A av RESOLVE en fas 2a/b-studie på RA-patienter som upplever en ofullständig eller förlorad respons på metotrexat. Dessutom ändrades den pågående fas 2a iMN-studien 2022 för att introducera den nya orala tablettdoseringsformen och för att öka behandlingstiden till 3 månader. De primära effektmåtten i EXPAND och RESOLVE uppnåddes inte, men post hoc-analyser visar på aktivitet i en bättre definierad patientpopulation och med tanke på säkerhetsprofilen stöder dessa data fortsatt utveckling av resomelagon för behandling av RA.
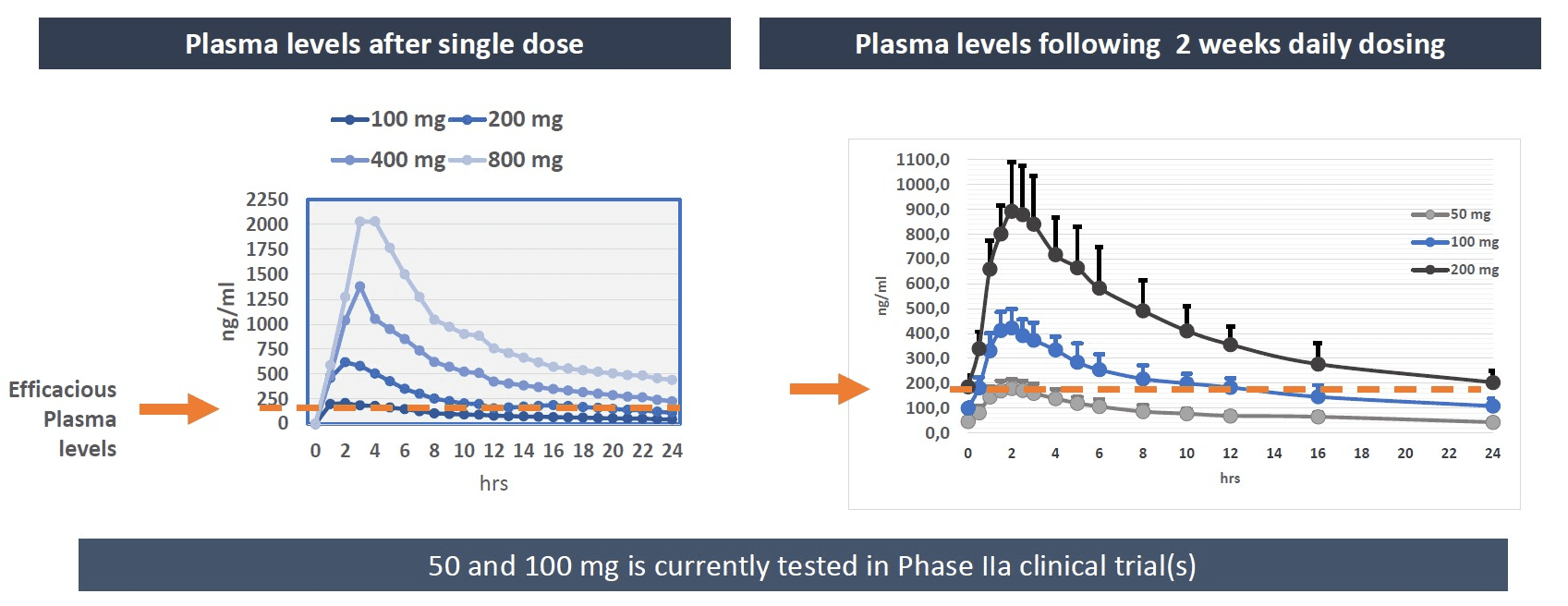
Fas 1 Utveckling
I den kliniska bedömningen i fas 1 med daglig administrering under två veckor fann man stöd för fortsatt utveckling av resomelagon (AP1189) som oralt administrerat läkemedel en gång dagligen. Den plasmakoncentration som behövs för att framkalla farmakologisk effekt uppnåddes inom 1,5 timmar efter administrering och den dagliga exponeringen ökades tills steady state uppnåddes efter 5–6 dagars behandling. Efter det sågs ingen ytterligare ackumulering av läkemedlet.
En jämförande farmakokinetisk studie, så kallad PK-studie, på friska frivilliga som doserades med suspensionen som användes i de tidiga kliniska faserna och tabletten som användes i EXPAND och RESOLVE, visade en liknande PK-profil för resomelagon (AP1189) efter dosering av endera av de två doseringsformerna.