Bakgrund om sjukdomen
Reumatoid artrit (RA) är en kronisk inflammatorisk sjukdom som vanligtvis drabbar mer än bara lederna. RA är en autoimmun sjukdom, dvs. en sjukdom som beror på oönskad aktivitet i immunsystemet, där immunsystemet av misstag angriper kroppens egna vävnader. RA påverkar ledernas inre beklädnad, vilket orsakar smärtsamma svullnader som så småningom kan resultera i benerosion och deformitet i lederna. RA är ofta förknippat med symtom som involverar andra delar av kroppen inklusive hud, ögon, lungor, hjärta och blodkärl. Initiala symtom är i de flesta fall ledvärk, artralgi, men utan kardinalartrit symtom på ömma och svullna leder. Symtom på artrit utvecklas gradvis över tiden. Ibland över veckor i andra fall över månader till år. Enligt riktlinjer (EULAR och FDA i Europa respektive USA) påbörjas inte behandlingen av dessa patienter före diagnosen RA. Diagnosen kan på grund av bristande tillgång till reumatolog bli avsevärt försenad och ofta behandlas patienter, i väntan på att bli utvärderade av en reumatolog, otillräckligt med smärtstillande medel inklusive NSAID (icke-steroida antiinflammatoriska läkemedel) och även med glukokortikoider.
Efter diagnosen RA kommer patienter med måttlig till hög sjukdomsaktivitet som förstahandsbehandling i de flesta fall att behandlas med det konventionella sjukdomsmodulerande antireumatiska läkemedlet (cDMARD) metotrexat (MTX). MTX har en långsam insättande effekt och en minskning av symtomen kan inte förväntas under de första veckorna av behandlingen. MTX-behandlingen kombineras därför ofta med dosering av glukokortikoider, vilket resulterar i mycket snabb minskning av symtomen, men glukokortikoider är förknippade med oönskade biverkningar. Riktlinjerna anger att användningen ska begränsas till kortvarig, och dosen av glukokortikoider ska minskas så snabbt som möjligt och dras tillbaka helt inom 3 månader. Många RA-patienter behandlas dock kroniskt med glukokortikoider.
Målet för första linjens behandling är att få sjukdomskontroll inom 3-6 månader från behandlingsstart. Sjukdomskontroll definieras som låg sjukdomsaktivitet eller sjukdomsremission. Många patienter svarar otillräckligt på förstahandsbehandlingen och kommer inte att uppleva sjukdomskontroll under den förväntade tidsperioden. I sådana fall en alternativ behandling, såsom en biologisk DMARD, t.ex. en TNF-hämmare, som kan inducera en högre grad av immunsuppression, kan läggas till eller kan ersätta MTX-behandlingen. Vissa patienter kommer inte heller att svara bra på denna behandling eller sluta svara med tiden, i vilket fall ett tredje behandlingsalternativ, såsom ett alternativt bDMARD eller de så kallade riktade syntetiska DMARDs, såsom JAK-hämmarna, bör erbjudas RA-patienterna.
Medan nya typer av mediciner har förbättrat behandlingsalternativen, finns det fortfarande betydande otillfredsställda behov. För patienter som inte är i sjukdomskontroll fortskrider RA fortfarande och skador ackumuleras. Patienter växlar ofta mellan behandlingar och klasser av terapier och måste hantera perioder av akut sjukdomsaktivitet som kallas skov, som kan inträffa flera gånger per år, och driver behovet av att justera dosen av nuvarande läkemedel eller att byta till en ny terapi för att behålla kontrollen över sjukdomen. Behandlingen av glukokortikoider är ofta förlängd under en längre tid med risk för allvarliga biverkningar. Dåligt kontrollerad RA orsakar mer patientinteraktion med hälso- och sjukvården och minskar patientens välbefinnande.
Ett patientvänligt och säkert behandlingsalternativ som tillägg till första linjens behandling, som skulle inducera sjukdomskontroll på ett glukokortikoidsparande sätt, med ytterligare potential att minska och/eller fördröja införandet av andra linjens behandlingar, kan tillgodose några av de otillfredsställda behoven hos RA-patienterna.
Klinisk utveckling av resomelagon (AP1189) vid RA
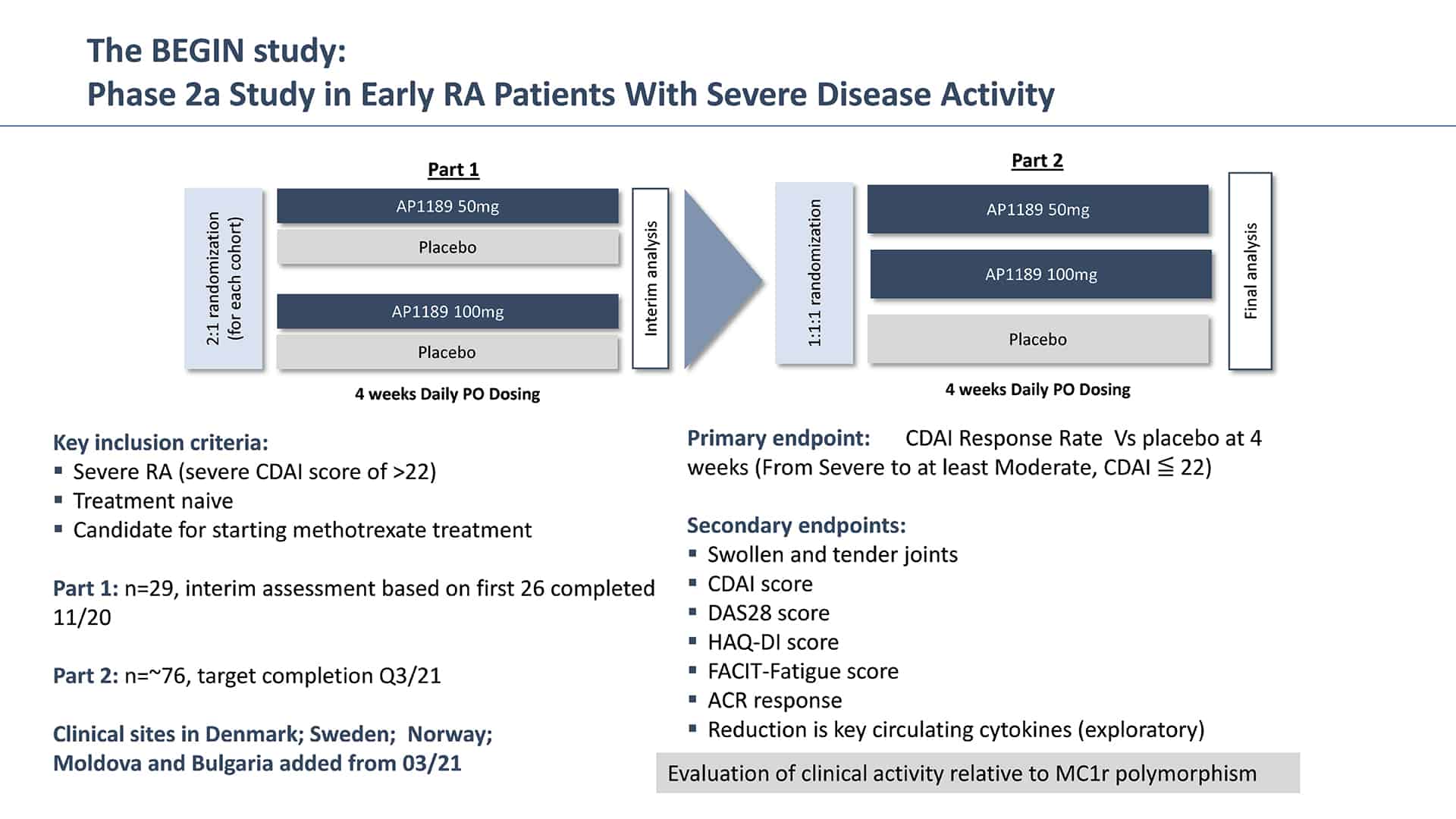
I november 2021 tillkännagav SynAct resultat från fas 2a-studien av resomelagon (AP1189) på nydiagnostiserade och tidigare obehandlade RA-patienter med allvarlig sjukdomsaktivitet. Studien, kallad BEGIN, var en randomiserad, dubbelblind, placebokontrollerad multicenterstudie på tidigare behandlingsnaiva RA-patienter där antingen 50 mg eller 100 mg AP1189 eller placebo administrerades utöver metotrexat (MTX).
AP1189 givet en gång dagligen i fyra veckor visade sig vara säkert och tolererades väl i den applicerade patientpopulationen. 100 mg AP1189 visade en statistiskt signifikant genomsnittlig minskning av det kliniska sjukdomsaktivitetsindexet (CDAI), studiens primära effektmått, från baslinjen till fyra veckor som var mer än 65 % högre än effekten som sågs i den placebobehandlade kontrollgruppen (genomsnittlig minskning av CDAI: AP1189 100 mg (n=33): 15,5 poäng jämfört med placebo (n=30): 9,3 %, p = 0,0394). 100 mg AP1189-gruppen visade också en signifikant högre andel patienter som uppnådde ACR20 än placebobehandlade patienter (ACR20: AP1189 (n=33) 100 mg: 60,6%; Placebo (n=30): 33,3%, P=0,0437) inom 4 veckor.
Fortsatt utveckling
Baserat på resultaten från BEGIN RA-studien har företaget genomfört ytterligare två kliniska fas 2-studier på RA med resomelagon (AP1189).
EXPAND – En 12-veckors fas2b-studie av daglig resomelagon (AP1189) i MTX-naiva patienter med svår sjukdomsaktivitet
EXPAND-studien utformades för att testa behandlingseffekten av 12 veckors resomelagon (AP1189) på sjukdomsaktivitet mätt med ACR20-svarsfrekvensen såväl som andra RA-sjukdomsåtgärder och för att bekräfta molekylens säkerhetsprofil. Bilden nedan ger en översikt över designen av EXPAND.
127 patienter med hög sjukdomsaktivitet (CDAI > 22) randomiserades 1:1 för behandling med en gång dagligen 100 mg resomelagon eller placebo som en bakgrund av MTX-terapi. 54,7 % av patienterna som behandlades med 100 mg oral resomelagon en gång dagligen uppnådde ett ACR20-svar efter 12 veckor jämfört med 55,7 % av patienterna som fick placebo.
Resomelagon fortsatte att visa en gynnsam säkerhetsprofil i denna högaktiva patientpopulation. Den totala frekvensen av allvarliga biverkningar (SAE) som uppträdde i behandlingen var 1,6 % (n=2), med 1 SAE i varje grupp. Den totala andelen patienter som upplevde behandlingsuppkomna biverkningar (AE) var 44,4 % och 42,2 % för resomelagon- respektive placebobehandlade patienter (alla patienter fick MTX). Det observerades inga tecken på immunsuppression i resomelagongruppen jämfört med den som är associerad med bakgrundsbehandling med metotrexat.
En post-hoc-analys utfördes av behandlingsnaiva reumatoid artritpatienter som hade en förhöjd baslinjenivå av C-reaktivt protein (CRP> 3mg/L), markör för systemisk inflammation och som inkluderades inom 6 månader efter diagnosen reumatoid artrit (RA). I denna subpopulation av patienter visade 100 mg daglig resomelagon ett konsekvent och statistiskt signifikant svar på terapi jämfört med placebo över bedömda resultatmått.
Efter 12 veckor hos EXPAND-patienter med förhöjd baslinje-CRP hade 100 mg resomelagongruppen en ACR20-uppnåelse på 71 % jämfört med 54 % av placebopatienterna. Vid 12 veckor i subpopulationen av patienter med förhöjt CRP som inkluderades och fick behandling påbörjad inom 6 månader efter deras RA-diagnos, uppnådde 23 av 28 (82 %) av patienterna som behandlades med 100 mg resomelagon en ACR20 jämfört med 14 av 27 (52 %) av placebopatienterna (P<0,05).
En signifikant skillnad som gynnar resomelagon sågs också över de sekundära utfallsmåtten inklusive minskningen av CDAI (resomelagon 24,6 vs placebo 14,7 poäng, p<0,01), minskning av DAS28-CRP (resomelagon 1,9 vs placebo 1,2 poäng, p<0,01) och minskning av HAQ 0,09 poäng för funktionshinder. p<0,05).
Säkerheten i den förhöjda CRP-populationen med behandling inom 6 månader efter var jämförbar med vad som tidigare rapporterats för hela EXPAND-studiepopulationen.
RESOLVE – 4/12-veckors fas 2a/b studie av daglig AP1189 hos patienter med ofullständigt svar på första linjens sjukdomsmodifierande antireumatiska läkemedel (DMARD-IR) som upplever måttlig till svår sjukdomsaktivitet
En stor andel av patienter som behandlas med DMARD uppnår aldrig den fulla önskade effekten, har en avtagande behandlingseffekt eller lider av biverkningar som kan förhindra fortsatt behandling. Dessa patienter som upplever en otillräcklig respons på DMARD-behandling kallas DMARD-IR (inadequate response).
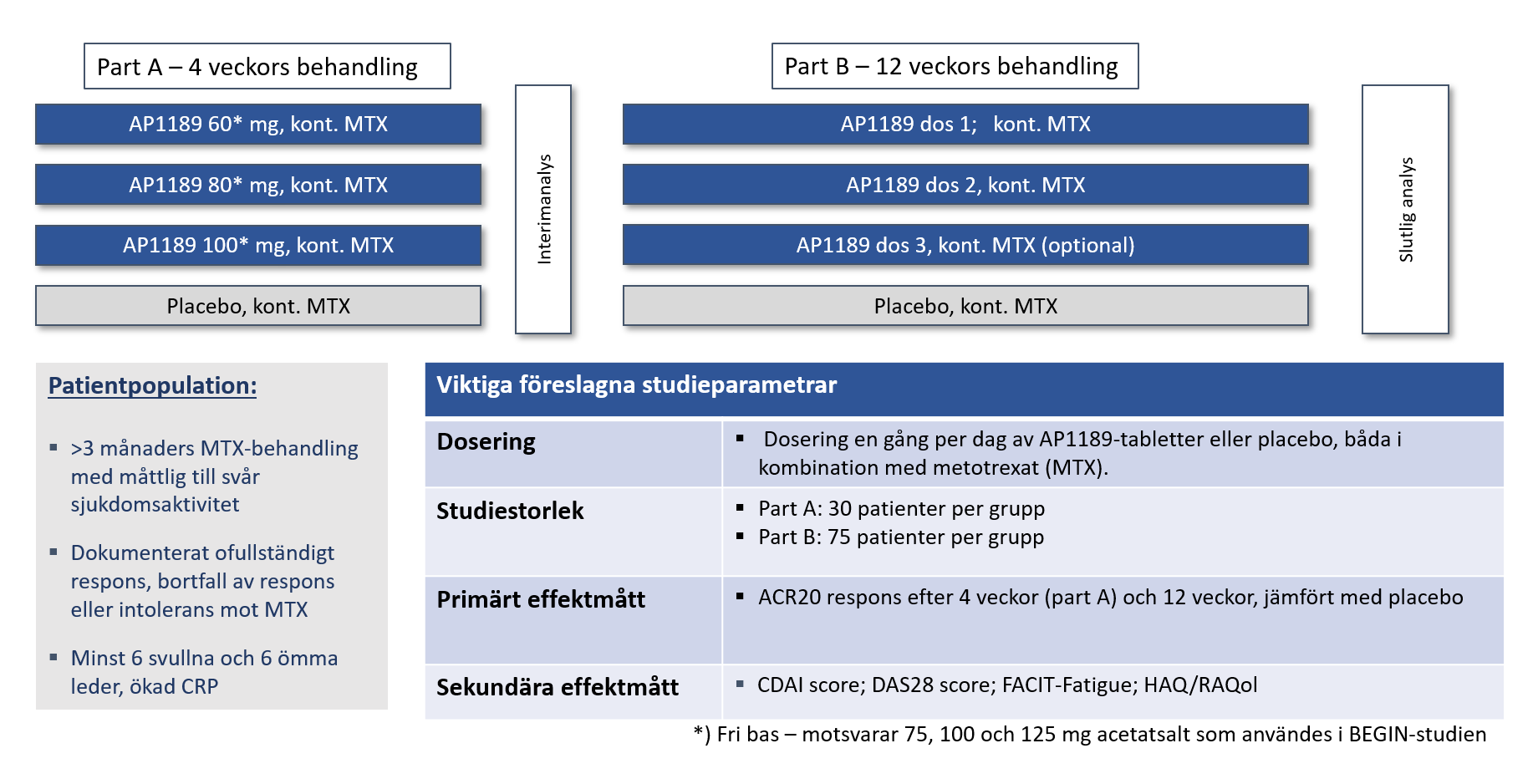
RESOLVE del A genomfördes under en US Investigational New Drug-ansökan som en fyra-armad, multi-site, studie med behandling av 60 mg, 80 mg, 100 mg resomelagon (AP1189) eller placebo en gång dagligen i 4 veckor.
Totalt inkluderades 125 patienter, varav 107 fullföljde Resolve del A per protokoll med dagliga doser av placebo, 60 mg, 80 mg eller 100 mg resomelagon under 4 veckor utöver en stabil dos av MTX.
Resomelagon fortsatte att vara allmänt säker och vältolererad jämfört med placebo. En allvarlig biverkning (SAE) rapporterades i studien hos en placebobehandlad patient som lades in på sjukhus på grund av allvarlig exacerbation av ledvärk. Det totala antalet rapporterade behandlingsuppkomna biverkningar (TEAE) var 56 av de 125 rekryterade patienterna med 16 i placebogruppen och 10, 12 och 18 i 60 mg, 80 mg respektive 100 mg resomelagongrupper.
En stor grad av heterogenitet i den rekryterade patientpopulationen identifierades vid analys av studien. Två tredjedelar av patienterna hade behandlats med metotrexat (MTX) i mer än ett år vid tidpunkten för rekryteringen och de flesta patienter behandlades i över 2 år med endast 5 avslutade patienter som hade en medicinsk historia av påbörjad MTX-behandling inom 6 månader efter diagnosen RA. Dessutom stödde inte medicinsk historia, som rapporterats, behandling med maximal tolererbar dos av metotrexat hos en bråkdel av de rekryterade patienterna.
Utveckling av resomelagon (AP1189) för behandling av DMARD-IR-patienter är fortfarande en möjlighet, men patientpopulationen måste väljas noggrant med tanke på substansernas verkningsmekanism och nyttan för de patienter som ska behandlas.
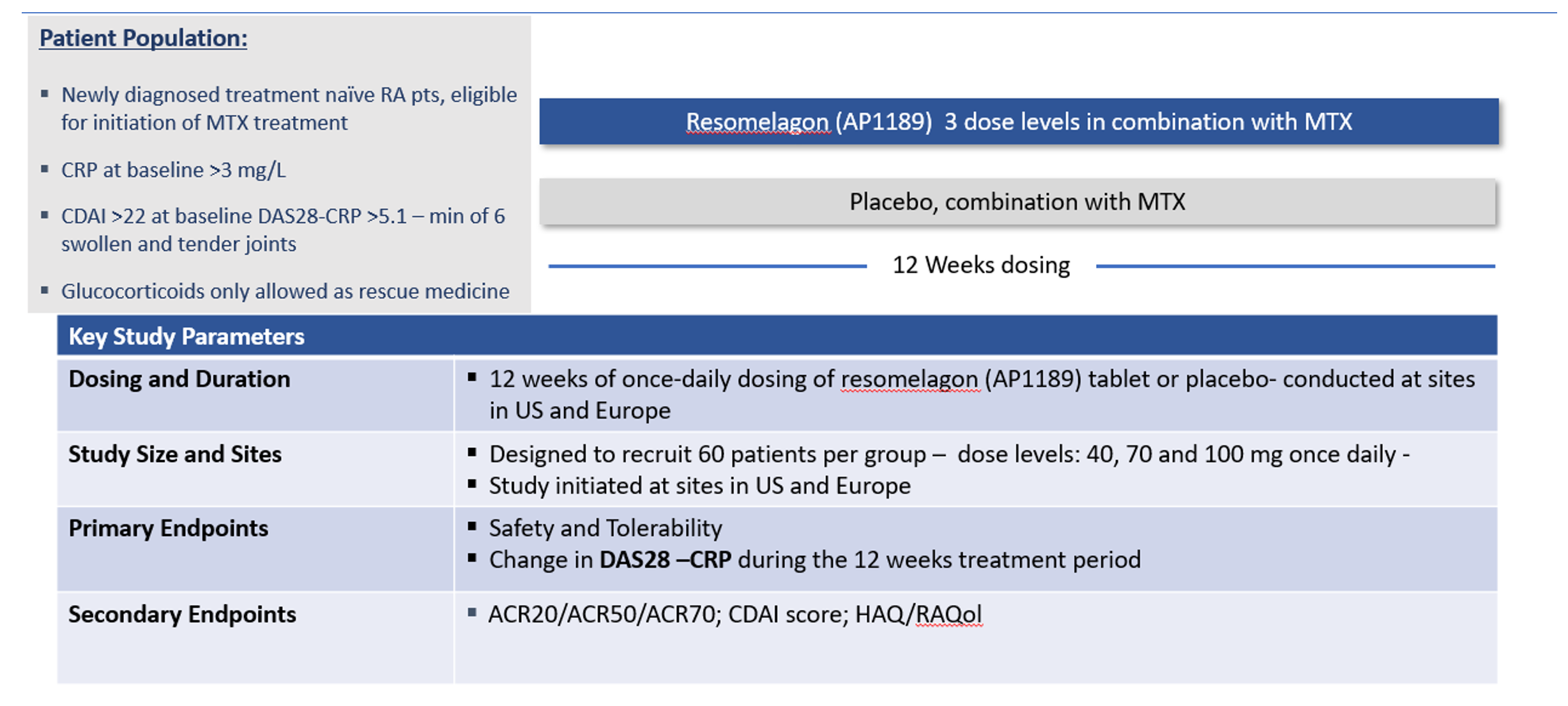
ADVANCE – En randomiserad, dubbelblind, placebokontrollerad, dosrespons, fas 2, multicenterstudie för att utvärdera effektiviteten och säkerheten av oralt AP1189 administrerat i doserna 40, 70 eller 100 mg under 12 veckor i kombination med metotrexat, hos DMARD-naiva deltagare med tidig artrit och aktiv artrit.
Baserat på post-hoc-analysen av resultatet av EXPAND, sattes ADVANCE-studien upp som fyra kohorter av RA-patienter, diagnostiserade inom 6 månader och som visar tecken på allvarlig RA (DAS28-CRP >5,1; CDAI >22) inklusive tecken på systemisk inflammation, definierad som hsCRP av en dos av 3 mg/placeboL eller 3 mg/placeboL. resomelagon (40, 70, 100 mg) en gång dagligen i 12 veckor i kombination med MTX-behandling. Studien är utformad för att randomisera 240 patienter med behandlingsinducerad minskning av DAS28-CRP som primär effektavläsning i linje med gällande riktlinjer från FDA och EMA. Patienter rekryteras på siteri USA och Europa.