Reumatoid artrit (RA) är en global sjukdom. För närvarande lever cirka 18 miljoner människor i världen med RA, och cirka en miljon nya patienter diagnostiseras varje år. Antalet ökar, framför allt i industriländerna, till följd av faktorer som befolkningstillväxt, förväntad livslängd, livsstil och förbättrad hälsovård.
Vad är RA?
RA är en kronisk inflammatorisk sjukdom som vanligtvis drabbar mer än bara lederna. RA är en autoimmun sjukdom, dvs. en sjukdom som beror på oönskad aktivitet i immunsystemet, där immunsystemet av misstag angriper kroppens egna vävnader. RA påverkar ledernas inre beklädnad, vilket orsakar smärtsamma svullnader som så småningom kan resultera i benerosion och deformitet i lederna.
Vilka symtom är förknippade med RA?
RA är ofta förknippat med symtom som involverar andra delar av kroppen inklusive hud, ögon, lungor, hjärta och blodkärl. Initiala symtom är i de flesta fall ledvärk, artralgi, men utan kardinalartritsymtomen på ömma och svullna leder. Symtom på artrit utvecklas gradvis över tiden. Ibland över veckor i andra fall över månader till år.
Dagens behandlingsalternativ
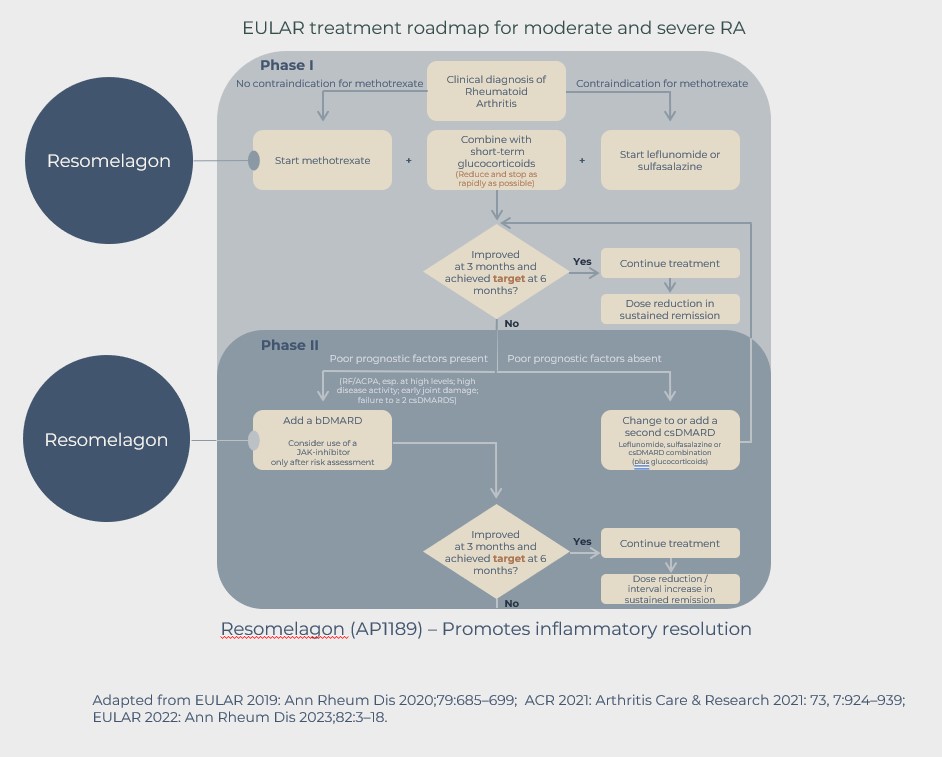
Enligt riktlinjer (EULAR och FDA i Europa respektive USA) påbörjas inte behandlingen av dessa patienter före diagnosen RA. Diagnosen kan på grund av bristande tillgång till reumatolog bli avsevärt försenad och ofta behandlas patienter, i väntan på att bli utvärderade av en reumatolog, otillräckligt med smärtstillande medel inklusive NSAID (icke-steroida antiinflammatoriska läkemedel) och även med glukokortikoider.
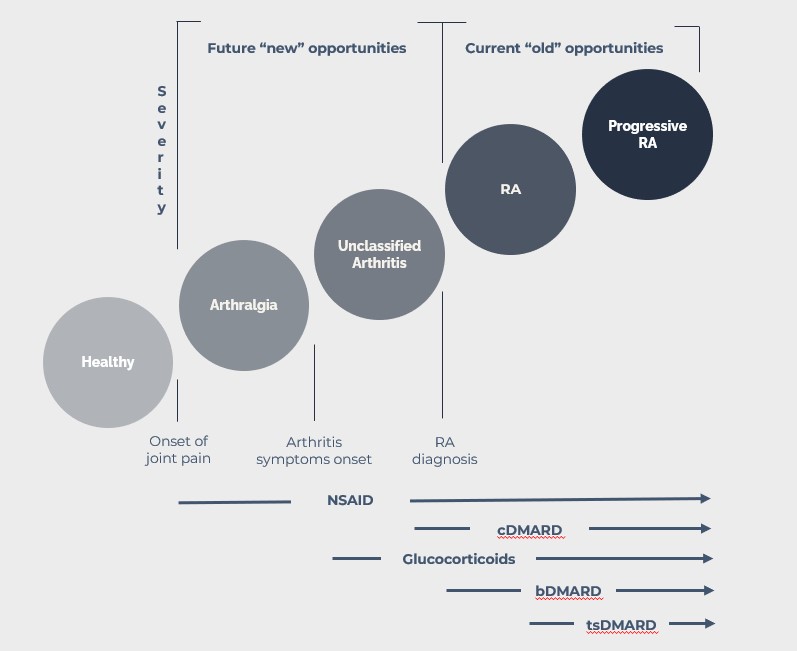
Efter diagnosen RA kommer patienter med måttlig till hög sjukdomsaktivitet som förstahandsbehandling i de flesta fall att behandlas med det konventionella sjukdomsmodulerande antireumatiska läkemedlet (cDMARD) metotrexat (MTX). MTX har en långsam insättande effekt och en minskning av symtomen kan inte förväntas under de första veckorna av behandlingen.
MTX-behandlingen kombineras därför ofta med dosering av glukokortikoider, vilket resulterar i mycket snabb minskning av symtomen, men glukokortikoider är förknippade med oönskade biverkningar. Riktlinjerna anger att användningen ska begränsas till kortvarig, och dosen av glukokortikoider ska minskas så snabbt som möjligt och dras tillbaka helt inom 3 månader. Många RA-patienter behandlas dock kroniskt med glukokortikoider.
Målet för första linjens behandling är att få sjukdomskontroll inom 3-6 månader från behandlingsstart. Sjukdomskontroll definieras som låg sjukdomsaktivitet eller sjukdomsremission. Många patienter svarar otillräckligt på förstahandsbehandlingen och kommer inte att uppleva sjukdomskontroll under den förväntade tidsperioden.
I sådana fall en alternativ behandling, såsom en biologisk DMARD, t.ex. en TNF-hämmare, som kan inducera en högre grad av immunsuppression, kan läggas till eller kan ersätta MTX-behandlingen. Vissa patienter kommer inte heller att svara bra på denna behandling eller sluta svara med tiden, i vilket fall ett tredje behandlingsalternativ, såsom ett alternativt bDMARD eller de så kallade riktade syntetiska DMARDs, såsom JAK-hämmarna, bör erbjudas RA-patienterna.
Behandlingsmöjligheten
Även om nya typer av läkemedel har förbättrat behandlingsalternativen, finns det fortfarande betydande otillfredsställda behov. För patienter som inte är i sjukdomskontroll fortskrider RA fortfarande och skador ackumuleras. Patienter växlar ofta mellan behandlingar och klasser av terapier och måste hantera perioder av akut sjukdomsaktivitet som kallas skov, som kan inträffa flera gånger per år, och driver behovet av att justera dosen av nuvarande läkemedel eller att byta till en ny terapi för att behålla kontrollen över sjukdomen.
Glukokortikoider används ofta under lång tid – data tyder på att upp till 50 procent av RA-patienterna har långvarig eller till och med kronisk användning, vilket ökar risken för allvarliga biverkningar.
Otillräckligt kontrollerad RA ökar belastningen på vården och påverkar patientens livskvalitet negativt.
Ett patientvänligt och säkert behandlingsalternativ som tillägg till första linjens behandling, som skulle inducera sjukdomskontroll på ett glukokortikoidsparande sätt, med ytterligare potential att minska och/eller fördröja införandet av andra linjens behandlingar, kan tillgodose några av de otillfredsställda behoven hos RA-patienterna.
Resomelagon har potential att uppfylla detta och kan, om det lyckas, integreras i RA-riktlinjerna.
